Química
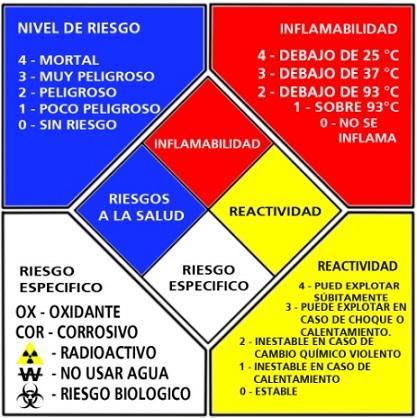
El inicio de clases respecto al curso de química es algo complicado, no porqué la materia sea dificil mas bien porque desde un inicio no tuvimos un maestro fijo y después de unas clases llego un suplente. La profesora Tania Lucero Gayosso Ricón nos imparte química de laboratorio, nos presentó la primera practica donde nos mostró una diapositiva con todas las normas de seguridad del laboratorio y las reglas a seguir, utilizamos conceptos como el rombo de seguridad y el código CRETIB.

El profesor Mohamed nos da las clases normales (teóricas) de química, estamos viendo los conceptos básicos como los modelos atómicos, los niveles del electrón y los números cuánticos.









Modelos atómicos
Los griegos, desde el siglo IV a. C, explicaron la composición de la materia mediante postulados.
Leucipo y su discípulo Demócrito sostenían que la materia se componía por átomos, sólidos, indivisibles y eternos. Entre estos existe solo el vacío. Difieren en su tamaño forma y distribución geométrica. Las propiedades de la materia varían según el agrupamiento de los átomos.
Posteriormente, se conoció que los átomos de todos los elementos están compuestos por las mismas partículas: neutrones, no tienen carga eléctrica, son neutros; protones, con carga eléctrica positiva; y loselectrones, que tienen carga eléctrica negativa. Los átomos se diferencian entre sí por el número de protones en sus núcleos.
Joseph John Thomson, físico británico, propuso un modelo atómico en 1904. Las cargas positivas del átomo se encontraban dispersas en todo su volumen.

Ernest Rutherford,
físico y británico, descubrió desviaciones de las radiaciones y (gamma) al atravesar una lámina de aluminio, y propuso un modelo en el que las cargas positivas deben estar en el núcleo; el diámetro del núcleo es aproximadamente 10.000 veces menor que el diámetro del átomo, y la mayor parte de un átomo son espacios vacíos.

Niels Bohr,
físico danés, propuso un modelo atómico planetario en el que las cargas positivas están en el núcleo parte central del átomo, mientras en la periferia y alrededor del núcleo están los electrones.

Arnold Sommerfield,
físico alemán en 1916, propuso un nuevo modelo que contempla órbitas elípticas y circulares, dado avance de la espectroscopia y la física cuántica, aparecen los subniveles de energía para los electrones.

Masa, Materia y Energía
MASA
La palabra masa tiene varias acepciones. Es un vocablo que proviene etimológicamente del latín "Masa". En física se llama masa, a la materia contenida en un cuerpo relacionada con la unidad de volumen. Se releva por su peso. La unidad de peso es el kilogramo. La masa atómica es el peso comparado de un núcleo atómico. La unidad de masa atómica es la doceava parte del carbono-12 y se simboliza con la letra "u". La relación entre masa y energía fue enunciada por Einstein, "La energía es proporcional a la masa de la que procede". (Kennet W. Whitten, 1992)
MATERIA
La materia es todo aquello que tiene masa y ocupa un lugar en el espacio. La masa es la medida de cantidad de materia contenida en una muestra de cualquier material. Mientras más masa tenga un objeto, más fuerza se requerirá para ponerlo en movimiento. Debido a que todos los cuerpos en el universo cumplen con la definición de materia, todos están formados por ella. Los sentidos de la vista y el tacto permiten reconocer que un objeto ocupa un lugar en el espacio. En el caso de gases incoloros, inodoros e insípidos (tales como el aire), los sentidos pueden fallar. (Kennet W. Whitten/Kennet D. Gailey/Raymond E. Davis, 1991)
ENERGÍA
La energía se define como la capacidad de realizar trabajo o transferir calor. Se conocen diversas formas de energía, que incluyen energía mecánica, eléctrica, calorífica y luminosa. Los vegetales utilizan la energía luminosa del sol para su crecimiento. La energía eléctrica permite iluminar un cuarto con solo cerrar un interruptor. La energía calorífica permite cocinar los alimentos y calentar los hogares. La energía se puede clasificar en dos tipos principales: Cinética y Potencial.
Un cuerpo en movimiento como una roca que se despeña, posee energía debido a su movimiento, este se denomina energía cinética y representa la capacidad de realizar un trabajo directo.
La energía potencial es la energía que posee un cuerpo debido a su posición o composición. El carbón, por ejemplo, posee energía química, una forma de energía potencial debido a su composición. Algunas plantas generadoras de electricidad utilizan carbón como combustible para generar calor y en forma subsistente energía eléctrica.[6]
Elementos, compuestos y mezclas
Las sustancias pueden ser elementos o compuestos. Un elemento es una sustancia que no se puede separar en otras más sencillas por medios químicos. Hasta la fecha se han identificado 117 elementos. La mayoría de ellos se encuentran de manera natural en la Tierra. Los otros se han obtenido por medios científicos mediante procesos nucleares.
Compuestos:
Están Conformados por más de un tipo de átomos. Se combinan de tal manera que ya no es posible identificarlos por sus propiedades originales e individuales y sólo una acción química los puede separar. Un ejemplo de esto son las joyas que para agregar resistencia se le agrega plata o bronce a algún elemento, metal precioso y no se nota la diferencia. (Chang, 2010)
Mezclas
una mezcla es la suma de dos o más sustancias en la que esta conserva sus propiedades. se puede tomar como ejemplo el aire, las bebidas gaseosas, la leche y el cemento.
las mezclas pueden ser homogéneas o heterogéneas:
Mezclas Homogéneas:
Son aquellas mezclas que sus componentes no se pueden diferenciar a simple vista. También se les conocen con el nombre de disoluciones y están constituidas por un soluto y un disolvente, siendo el primero el que se encuentra en menor proporción y además suele ser el líquido.
Mezclas Heterogéneas:
Son aquellas mezclas en las que sus componentes se pueden diferenciar a simple vista.
Estados de la materia
La materia se clasifica en tres estados. En el estado solido las sustancias son rígidas y tienen forma definida. El volumen de los mismos no varía en forma considerable con cambios de temperatura.
En los solidos denominados cristalinos, ocupan posiciones definidas en la estructura. Las fuerzas de interacción entre las partículas individuales determinan la dureza y la resistencia del cristal.

En estado líquido las partículas individuales están confinadas en un volumen dado. Los líquidos fluyen y toman la forma del recipiente que los contiene. Es muy difícil comprimir líquidos.

Un ejemplo común es el agua. Los Gases son menos densos que los líquidos y los sólidos, y ocupan todo el recipiente que los contiene; pueden expandirse hasta el infinito y se comprimen con facilidad. Se concluye que los gases consisten principalmente de espacio vacío; esto es, las partículas individuales están bastante separadas
El plasma materia gaseosa fuertemente ionizada con igual número de cargas eléctricas positivas y negativas (iones +/-) (electrones-). Nombrado así plasma por primera vez en 1920 Irving Langmuir. (Tanarro) La El plasma se obtiene al inducir a un gas a alta temperatura, o a una gran voltaje. Son múltiples sus usos como Propulsores espaciales, Tv y fusión nuclear.

Propiedades Físicas y Químicas del agua
El agua es una molécula formada por dos elementos, hidrógeno y oxígeno. Contiene dos átomos de hidrógeno y uno de oxígeno. La molécula del agua es dipolar: tiene un polo positivo por parte del hidrógeno y uno negativo debido al oxígeno. El agua tiene otras propiedades físicas. Aún siendo incolora, toma un tono azulado cuando se mira a través de espesores de seis metros o más. Esto se debe a que absorbe las radiaciones rojas.
No posee una forma definida, por eso es que toma la forma del recipiente que la contiene y, sin embargo, su superficie conserva una posición horizontal. La densidad se define como la relación de la masa entre el volumen; 1 kilo de agua ocupa el volumen de 1 litro. Además, el agua es el medio en que se disuelven casi todas las sustancias y se producen muchas reacciones químicas.
El agua tiene una fuerza con la que empuja, esto se llama presión. También tiene tensión superficial, producida por la fuerte unión entre sus moléculas: si dejamos caer una aguja engrasada al agua ésta no tendrá suficiente peso para romper la tensión de las moléculas en la superficie y, por lo tanto, flotará. Su punto de congelamiento es de 0ºc en el cual se convierte en hielo y el de ebullición es el100ºc al nivel del mar, en este punto el agua se transforma en vapor.

El cambio de solido a gaseoso se le llama sublimación porque no pasa por el estado liquido, asi mismo el cambio de liquido a gaseoso es evaporación, de liquido a solido es solidificación, de solido a liquido fusión, y de vapor a liquido condensación, el vapor de agua pesa menos que el aire, por lo mismo el vapor sube a grandes alturas donde desciende la temperatura a tal grado que provoca que moléculas de agua se congelen y chocan unas con otras creando pequeños pedacitos de hielo o nieve.
El agua pura no es potable, se necesita agregarle algunas sales y minerales para hacerla bebible así de esta manera no es perjudicial para el organismo, el cuerpo humano de un niño contiene un 85% de agua en su interior, conforme la persona envejece puede disminuir este porcentaje considerablemente hasta un 60% en un hombre adulto y un 45% en una mujer adulta.[15]
El ciclo de vida del agua es eterno el problema hoy en día es la distribución de ella en el mundo

Separaciones
Las mezclas de elementos y compuestos rara vez se encuentran en la naturaleza en forma pura, o casi puras, por lo que es necesario separarlos en las mezclas en las que se encuentran. Cuando se prepara un compuesto en el laboratorio, se requieren de varios pasos para separarlos en forma pura de la mezcla de reacción donde se formó. A continuación se describen algunos métodos para separar las sustancias puras de la mezcla:
Filtración
La filtración es el proceso para separar los sólidos que se encuentran suspendidos en líquidos al pasar la mezcla a través de un embudo de filtración; cuando el líquido atraviesa el filtro, las partículas se retienen en él. (Kennet W. Whitten, 1992)
Destilación
Un líquido que se vaporiza fácilmente se le llama líquido volátil. La destilación es el método por el cual se puede separar en sus componentes una mezcla que contenga sustancias volátiles. Por ejemplo, si se calienta una solución salina, el agua, que es el componente más volátil, se evapora dejando atrás la sal sólida. (Kennet W. Whitten, 1992)
Tamización
El tamizado es uno de los métodos de separación de mezclas, el cual consiste que mediante un tamiz , zarandas o cernidores (redes de mallas más o menos gruesas o finas) se separan partículas sólidas según su tamaño.
Se coge un tamiz que deje pasar el polvo más fino y retenga el más grueso. Por ejemplo en los molinos es utiliza este procedimiento para separar la harina del afrecho.
(Kennet W. Whitten, 1992)
Flotación
Se denomina flotación a la operación en la que un sólido se separa de otro, basándose en que uno de ellos sobrenada en la superficie de un líquido. En las modernas técnicas de flotación con espumas, las partículas sólidas se mantienen constantemente agitadas con agua sobre la que se mantiene una capa de espuma espesa. Debido a las distintas propiedades superficiales de los cuerpos sólidos, uno de ellos absorbe con más facilidad la fase acuosa, se moja perfectamente y se hunde en el líquido. El otro sólido, en cambio, adsorbe con preferencia al aire, quedando recubierto total o parcialmente por la fase gaseosa; la densidad aparente de las partículas de este sólido adherido a las burbujas de aire resulta menor que la del agua, por lo que el conjunto flota y se sostiene en la superficie del líquido formando una espuma mineralizada, que puede rebosar continuamente por el borde superior de la cuba de flotación. Dado que la separación por flotación con espumas depende solamente de las características superficiales de los sólidos, la separación de estos se logra con entera independencia de cuales sean sus densidades respectivas.
(Kennet W. Whitten, 1992)
Cristalización.
Técnica de separación de disoluciones en la que las condiciones se ajustan de tal forma que sólo puede cristalizar alguno de los solutos permaneciendo los otros en la disolución. Esta operación se utiliza con frecuencia en la industria para la purificación de las sustancias que, generalmente, se obtienen acompañadas de impurezas. (Kennet W. Whitten, 1992)


Comentarios
Publicar un comentario